
|
|

 |
|
 |
Le Streptocoque du groupe B, première cause d'infections néonatales graves. Epidémiologie et stratégies de prévention.
P. MELIN(1) , M. SCHMITZ(1)
, P. DE MOL(1) , JM. FOIDART(2) et J. RIGO(3)
Les premiers cas d’infection néonatale
à streptocoques du groupe B (SGB) ont été décrits
par Eickhoff et al. en 1964 (1). Et depuis son émergence en pathologie
infectieuse néonatale dans les années 70, le SGB est devenu
la première cause d’infection bactérienne sévère
du nouveau-né (2-4). Cette augmentation de l’incidence des septicémies
et méningites néonatales à SGB a été
observée dans tous les pays industrialisés. Ces infections
sont le plus souvent transmises verticalement. Malgré les progrès
thérapeutiques, ces infections néonatales restent associées
à une morbidité et une mortalité importantes. En Belgique,
150 à 300 nouveau-nés présentent chaque année
une infection grave à SGB et plus de 10 % en meurent. Depuis 1983,
ces infections représentent 36 % des septicémies et méningites
néonatales (0-28 jours) déclarées par un réseau
de laboratoires vigies belges (5). Comparativement E. coli, S. epidermidis
et
S. aureus sont respectivement responsables de 18, 11 et 10 % des septicémies
et méningites néonatales (5). La plupart de ces infections
à SGB pourraient être prévenues par l’administration
intrapartum (c’est-à-dire pendant l’accouchement dès le début
du travail si possible) d’une antibioprophylaxie aux mères d’enfant
à risque de développer une infection précoce. Une
large étude prospective de surveillance épidémiologique
et des moyens logistiques disponibles en Communauté Française
vient de commencer et se poursuivra pendant l’année 1999. Au terme
de cette étude et en consensus entre les gynécologues-obstétriciens,
les microbiologistes et les pédiatres nous espérons être
en mesure de proposer des recommandations de prévention appropriées
à notre pays.
retour au sommaire
Colonisation asymptomatique
Les SGB sont des commensaux occasionnels
du tractus gastro-intestinal et des voies génitales de la femme.
Les taux de colonisation peuvent varier selon les groupes ethniques, les
localisations géographiques et l’âge (12, 13). Actuellement,
la prévalence de colonisation vaginale et rectale de la femme enceinte
varie de 10 à 15 % en Europe du Nord et de 20 à 30 % en Amérique
du Nord (14, 15). Ces variations dans les prévalences publiées
sont en partie attribuables à des différences méthodologiques
de culture (16) mais sont surtout associées aux caractères
des populations étudiées. Cette colonisation est dynamique
: elle peut être transitoire, intermittente ou continue (13, 15,
17). La colonisation est en général asymptomatique. Seuls
des examens bactériologiques peuvent reconnaître les porteurs
de SGB.
Transmission aux nouveau-nés
Environ la moitié des enfants nés
d’une mère colonisée vont acquérir ce SGB dans la
période périnatale. Le nouveau-né peut devenir colonisé
ou infecté par quatre voies différentes (18-20). La voie
la plus importante est la colonisation directe in utero par voie ascendante,
le plus souvent après rupture de la poche des eaux . Mais le nouveau-né
peut aussi acquérir le SGB par contact ou inhalation lors du passage
dans la filière génitale ou encore par voie sanguine. Le
dernier mode d’acquisition est la transmission horizontale, après
la naissance, par contact avec une personne colonisée ou transitoirement
contaminée si les conditions d’hygiène sont mauvaises (lavage
des mains insuffisant) (21, 22).
Incidence de l’infection néonatale
précoce et séro-épidémiologie
Alors que la majorité des bébés
colonisés restent asymptomatiques, 1 à 4 % développent
une infection cliniquement apparente et démontrée par une
hémoculture ou culture de liquide céphalo-rachidien (LCR)
positives à SGB, soit 1 à 3 cas d’infection précoce
pour 1000 naissances en vie (23, 24). En plus de ces cas, 1 à 4
autres% développent une infection cliniquement apparente mais non
confirmée par une hémoculture ou culture de LCR positive
à SGB, mais fortement suggérée par un antigène
urinaire SGB positif et des cultures cutanéo-muqueuses SGB-positives.
Tous les sérotypes sont rencontrés avec une prédominance
du sérotype III, suivi en Belgique par les sérotypes Ia et
II. La figure 1 présente la distribution des sérotypes de
56 souches isolées lors d’infection précoce en Belgique entre
1995 et 1997 (25).
Infections chez
le nouveau-né
Chez le nouveau-né, l’infection
à SGB présente deux formes cliniques différentes (tableau
I).
L'infection précoce ("early
onset GBS disease") se déclare
pendant les cinq premiers jours de vie, presque immédiatement à
la naissance avec une moyenne d’âge de 1 à 10 heures de vie
(26). Elle se produit typiquement après la colonisation de l’utérus
et/ou du placenta suite à l’ascension du SGB vaginal (1, 18, 27).
Elle est caractérisée par le développement rapide
d’une détresse respiratoire sévère, d’une septicémie
avec état de choc, d’une coagulation intravasculaire disséminée
et d’une défaillance des organes vitaux. Ce tableau clinique est
éventuellement accompagné d’une méningite. En dépit
d’une antibiothérapie adéquate, la mortalité est encore
de 5 à 20 % (24, 28, 29) et plus de 30 % des enfants atteints de
méningite gardent des séquelles neurologiques importantes
(cécité, surdité, retard mental).
L’infection tardive ("late onset
GBS disease") se produit dans les premiers mois de vie au-delà
de la première semaine avec une moyenne d’âge d’un mois, et
avec une incidence de 0,5 à 1 cas pour 1000 nouveau-nés (30).
Elle résulte en général d’une transmission horizontale
et affecte le plus souvent des enfants en bonne santé. Contrairement
au sepsis rencontré dans l’infection précoce, l’infection
tardive est caractérisée par de la fièvre, une bactériémie
et le plus souvent une méningite. L’arthrite septique, l’ostéomyélite
et la cellulite sont d’autres manifestations de cette forme. Le sérotype
III est isolé dans plus de 90 % des cas. La mortalité est
moins élevée que dans l’infection précoce, mais les
séquelles sont beaucoup plus importantes, en raison de la fréquence
des méningites.
Tableau 1 : Caractéristiques
des infections néonatales à SGB
|
|
|
|
|
Incidence
|
|
|
|
Début
|
(moyenne: 1 -10 heures ) |
( moyenne:1 mois) |
|
Acquisition
|
Intrapartum |
A l'accouchement ? Nosocomiale ? Dans la communauté ? |
|
Caractéristiques
cliniques
|
avec pneumonie Sepsis (Méningite : 5-15%) |
Bactériémie Méningite (Ostéomyélite) |
|
Mortalité
|
|
|
|
Sérotypes
|
(surtout III, Ia et II) |
|
Infections chez la
femme enceinte
Chez la femme enceinte, le SGB peut donner
une infection urinaire, une pyélonéphrite, une chorio-amniotite,
une endométrite ou une infection de plaie et est responsable de
15 à 25 % des états fébriles du post partum (31, 32).
La relation entre la colonisation vaginale par SGB et un travail ou une
rupture de poche prématurés est complexe et difficile à
évaluer.
Infections chez l’adulte
Les infections invasives à SGB
rencontrées chez l’adulte sont le plus souvent des infections de
la peau et des tissus mous, des bactériémies sans foyer connu,
des bactériémies à point de départ urinaire,
des endocardites, des pneumonies et des méningites. Le taux de mortalité
est élevé et varie de 20 à plus de 50 % (30, 33).
Etant donné la voie de transmission,
le principal facteur de risque est la colonisation vaginale maternelle
au moment de l’accouchement. Le taux d’infection augmente aussi avec
le degré de colonisation : 85 % des enfants développant une
infection précoce sont nés de mères très colonisées
(17, 19, 34).
D’autres facteurs de risque comprennent
la notion d’antécédent d’infection à SGB lors d’une
naissance antérieure (28) et une bactériurie à
SGB pendant la grossesse en cours, reflétant probablement une
faible réponse immunitaire maternelle anti-SGB. La prématurité
(moins de 37 semaines) augmente aussi la vulnérabilité des
nouveau-nés à l’infection à SGB. Le facteur spécifique
contribuant est le taux peu élevé d’anticorps (IgG) dirigés
contre les antigènes capsulaires de type, en relation avec un faible
transfert transplacentaire des IgG maternelles à ce stade de la
grossesse (30, 35). La rupture prolongée de la poche des eaux
(> à
18 h) (36, 37) et la fièvre
(> à
38°C) au cours du travail sont
également associées au risque d’infection précoce
(3, 4, 24, 26).
retour au sommaire
Pendant ces 20 dernières années,
plusieurs stratégies de prévention ont été
étudiées. Deux approches théoriques ont été
envisagées: la vaccination et la chimioprophylaxie.
La vaccination
La vaccination des jeunes filles ou des
femmes enceintes pendant le premier trimestre de la grossesse préviendrait
au plus 85 % des infections néonatales précoces et tardives.
Cette approche rencontre deux principaux obstacles (38-41). D’une part,
les anticorps maternels ne traversent pas le placenta avant 32 semaines
de gestation : les grands prématurés, particulièrement
sensibles à cette infection, ne seraient donc pas protégés
par cette stratégie. D’autre part, différentes préparations
vaccinales à base d’antigènes capsulaires polysaccharidiques
(peu immunogènes) des principaux sérotypes (Ia, Ib, II, III
et V) sont toujours en développement et en cours d’évaluation
(42, 43).
La chimioprophylaxie
Une des premières stratégies
était d’identifier les mères colonisées et de les
traiter pendant la grossesse. Mais ce fut un échec car les femmes
se recolonisent régulièrement tout au long de la grossesse,
soit à partir de leur tractus gastro-intestinal, soit par leurs
rapports sexuels (12, 14, 44, 45).
Le traitement de tous les enfants juste
après la naissance fut également un échec. En effet,
l’infection débute in utero, et peut déjà être
bien installée lorsque le traitement postnatal est instauré
(37).
Actuellement, la seule stratégie
démontrée efficace est d’identifier les foetus à
risque de développer une infection à SGB précoce et
d’administrer à leurs mères une antibioprophylaxie intrapartum
(46-50). Cette stratégie est la base des recommandations de l’ACOG
(American College of Obstetricians and Gynecologists), de l’AAP (American
Academy of Pediatrics) et du CDC (Centers for Diseases Control and Prevention).
En 1992, l’ACOG et l’AAC ont publié des recommandations assez différentes
pour l’identification et le traitement des mères des enfants à
risque de développer une infection précoce (51, 52). L’ACOG
recommandait de ne pas faire de dépistage prénatal de colonisation
et de traiter toutes les mères présentant des facteurs de
risque d’infection néonatale. Par contre, l’approche de l’AAP suggérait
un dépistage recto-vaginal de colonisation à SGB à
la fin du deuxième trimestre de grossesse. Si les mères étaient
identifiées comme colonisées et avaient au moins un autre
facteur de risque, l’AAP recommandait une administration intrapartum d’antibiotique.
L’efficacité de ces stratégies
a été évaluée (53, 54) et leurs discordances
d’attitude ont conduit à une certaine confusion. En 1996, le CDC
publiait des recommandations reflétant un compromis raisonnable
entre ces deux types de stratégies (55).
Recommandations du CDC(43) retour au sommaire
- Les obstétriciens, en collaboration
avec les laboratoires et les maternités, doivent adopter une stratégie
de prévention de l’infection néonatale précoce à
SGB.
- Quelle que soit la stratégie
suivie,
Approche basée sur le dépistage (premier choix) (fig. 2). Un dépistage ano-vaginal est réalisé chez toutes les femmes entre les 35-37èmes semaines. Si la culture est positive, on administre des antibiotiques pendant le travail. Si le statut de colonisation est inconnu, une antibioprophylaxie intrapartum s’impose en présence d’un état fébrile (> à 38°C) ou d’une rupture de la poche des eaux de plus de 18 heures.
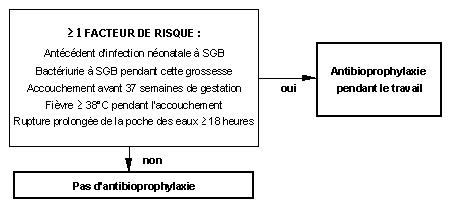
Approche basée sur les facteurs de risque (alternative acceptable) (fig. 3). En plus des trois situations décrites précédemment, une antibioprophylaxie est aussi indiquée chez toutes les parturientes qui présentent au moins un des facteurs de risque suivants : rupture de la poche des eaux de plus de 18 heures ou température > à 38°C.
Fig 2 : Algorithme pour la
prévention des infections néonatales précoces à
SGB
Approche basée sur un dépistage à 35-37 semaines
de gestation

Figure 3 : Algorithme pour la prévention
des infections néonatales précoces à SGB
Approche basée sur les facteurs de risque
- Les propositions d’antibioprophylaxie
intrapartum (tableau II) sont
les suivantes: soit la pénicilline G en iv, 5 millions U initialement
en début de travail et puis 2,5 millions U toutes les 4 heures jusqu’à
l’accouchement, soit l’ampicilline iv (2 g initialement suivis de 1 g toutes
les 4 heures). La préférence est donnée à la
pénicilline pour son spectre d’activité plus étroit
et à moindre risque de sélectionner des résistances.
Pour les patientes allergiques à
la pénicilline, la clindamycine (900 mg iv toutes les 8 heures)
ou l’érythromycine (500 mg en iv toutes les 6 heures) peuvent être
utilisées. Les femmes recevant déjà des antibiotiques
actifs sur le SGB pour le traitement d’une chorio-amniotite par exemple,
ne doivent plus recevoir un traitement complémentaire par la pénicilline.
| Recommandé | Pénicilline G, 5 mU en IV initialement et puis 2,5 mU en IV toutes les 4 heures jusqu'à l'accouchement | |
| Alternative | Ampicilline, 2 g en IV initialement, et puis 1 g en IV toutes les 4 heures jusqu'à l'accouchement | |
| Si allergie à la pénicilline | ||
| Recommandé | Clindamycine, 900 mg en IV toutes les 8 heures jusqu'à l'accouchement | |
| Alternative | Erythromycine, 500 mg en IV toutes les 6 heures jusqu'à l'accouchement | |
Figure 4 : Algorithme pour la prise en charge et l'évaluation des enfants nés de mères ayant reçu une antibioprophylaxie pendant le travail (API)
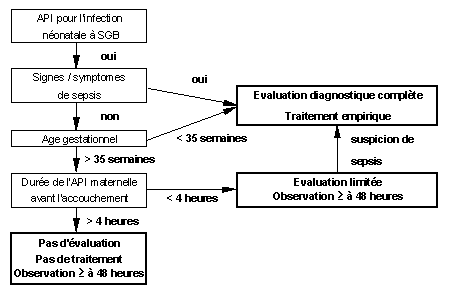
Un élément clé
dans ces stratégies de prévention est l’identification des
parturientes colonisées, pour la sélection des candidates
à l’antibioprophylaxie. Demandant un minimum de 15 à 18 heures
pour leur lecture, les cultures vaginales, réalisées en début
de travail ne peuvent donc pas être utilisées dans ce but.
Le statut de colonisation vaginale peut fluctuer tout au long de la grossesse.
Pour cette raison, les valeurs prédictives d’un dépistage
prénatal sur la colonisation au moment de l’accouchement varient
inversement avec le temps écoulé entre le dépistage
et l’accouchement. Trois à quatre semaines avant l’accouchement,
les valeurs prédictives positive et négative du dépistage
sont respectivement de 88 et 96 % (56), alors que la valeur prédictive
positive est de 43 % seulement pour les dépistages réalisés
plus de 6 semaines avant l’accouchement.
Pour optimaliser le dépistage prénatal
à réaliser entre 35 et 37 semaines :
- un prélèvement vaginal
(tiers distal) et un prélèvement anorectal doivent être
effectués et transportés dans un milieu de conservation (Amies,
par ex.).
- la prescription d’analyse doit spécifier
qu’il s’agit d’un dépistage de SGB prénatal.
- en plus d’un milieu de culture habituel,
un bouillon d’enrichissement sélectif (type Todd-Hewitt + colistine
/ ac. nalidixique ou + gentamicine / ac. nalixique) doit être inoculé
au laboratoire. Après 18-24 h d’incubation à 35°C, le
bouillon est sous cultivé sur une gélose au sang. Avant de
répondre une recherche de SGB négative, les milieux solides
doivent être incubés 48 h à 35°C en aérobiose
+ 5-7 % CO2.
L’alternative idéale de ces recommandations
est l’utilisation d’un test rapide de détection d’antigène
chez les parturientes. Cette mise en évidence extemporanée
de la présence de SGB devrait être plus efficace pour identifier
les mères colonisées à l’accouchement et candidates
à l’antibioprophylaxie. Quelques tests ont été développés
(57) mais un seul, le Strep B OIA de Biostar (Boulder, Co, USA), présente
des caractéristiques de sensibilité et de spécificité
acceptables. Lors d’une évaluation du Strep B OIA réalisée
à Liège en 1996-1997 sur des échantillons vaginaux
prélevés chez des parturientes dès leur admission
à la maternité, ses valeurs prédictives positive et
négative par rapport à la culture étaient de 86 %
et 99 % respectivement. Ce test a montré une excellente sensibilité
(96 %) chez les parturientes faiblement à très colonisées
(58). Il est réalisé en 30 minutes, mais il présente
cependant quelques contraintes de procédure limitant ainsi son utilisation
en routine dans un laboratoire d’urgence.
retour au sommaire
Pour mieux comprendre les rapports
coût/bénéfice de la prophylaxie en fonction des différentes
stratégies, comparons leurs efficacités théoriques
(tableau III). Formulons l’hypothèse d’une population de 1000 femmes
enceintes, avec soit une prévalence de colonisation vaginale par
SGB de 20 % et vaginale + anorectale de 25 % (comme en Amérique
du Nord), soit une prévalence de colonisation vaginale par SGB de
12 % et vaginale + anorectale de 16 % (comme en Belgique), une incidence
d’infection néonatale précoce confirmée de 2/1000
nouveau-nés (soit environ la moitié des cas réels:
cas confirmés + suggérés) et une prévalence
d’accouchement avec au moins un facteur de risque associé au développement
d’une infection néonatale précoce de 20 %. En prenant en
compte les sensibilités, spécificités, valeurs prédictives
positives et négatives des différentes techniques de dépistage,
nous avons évalué, pour chaque stratégie, le pourcentage
maximal de cas prévenus et le nombre de chimioprophylaxies intrapartum
à engager pour prévenir au moins un cas d’infection néonatale
précoce.
Prenons comme référence la stratégie "universelle" consistant à administrer une antibioprophylaxie à toutes les parturientes. Elle permettrait au mieux de prévenir 85 à 89 % des cas d’infection précoce. Pour prévenir une seule infection, il faudrait traiter 588 mères, ce qui ne serait pas rationnel, sans compter le risque de réactions anaphylactiques et d’émergence de germes résistant aux antibiotiques utilisés. Si la notion de facteurs de risque (ACOG et alternative du CDC) reste intéressante dans les populations où la prévalence du portage vaginal est importante, elle l’est beaucoup moins dans les populations où cette prévalence est moindre comme en Belgique et en Europe du Nord en général. Pour la Belgique, la première proposition du CDC basée sur un dépistage prénatal à 35-37 semaines ou mieux encore une variante basée sur un dépistage rapide de colonisation vaginale réalisé en début de travail, représenteraient des attitudes plus rationnelles.
Tableau 3 :Conséquences et
efficacité théoriques de différentes stratégies
de prévention des infections néonatales précoces à
SGB.
| Universelle | AAP(1992) | ACOG/CDC(II) | CDC(I) | CDC variante | |
| IAP | à toutesles femmes | si SGB 26-28s.positif etfacteur de risque | si facteurde risque | si SGB 35-37s.positif | si SGB testrapide enintrapartumpositif |
| Nb API / 1000 naissances | 1000 | 50 (32)* | 200 (200)* | >250 (>160)* | 230 (158)* |
| Nb API / cas prévenu | 588 | 79 (51)* | 157 (157)* | >166 (>107)* | 150 (103)* |
| % Cas prévenus | 85 | 31,5 | 63 | 75 | 76,5 |
API= AntibioProphylaxie Intrapartum.
N= Valeurs calculées
pour colonisation vaginale + rectale de 25%, comme en Amérique du
Nord.
( N' )*= Valeurs calculées
pour colonisation vaginale + rectale de 16%, comme en Belgique probablement.
Pour choisir la stratégie de prévention
la plus adaptée à une population, la prévalence de
la colonisation des femmes enceintes par SGB, la prévalence des
accouchements "à risques" et l’incidence de l’infection néonatale
doivent être connues. Dans cette perspective, une large étude
prospective de surveillance épidémiologique et des moyens
logistiques disponibles en Communauté Française vient de
commencer et se poursuivra pendant l’année 1999.
retour au sommaire
1. Eickhoff TC, Klein JO, Daly AK, et al.— Neonatal sepsis and other infections due to Group B beta-hemolytic streptococci. N Engl J Med,1964, 271, 1221-8.2. McCracken GH.— Group B streptococci: the new challenge in neonatal infections. J Pediatr, 1973, 82, 703-6.3. Baker CJ, Barrett FF.— Transmission of group B streptococci among parturient women and their neonates. J Pediatr, 1973, 83, 919-25.4. Baker CJ, Barrett FF, Gordon RC, et al.— Suppurative meningitis due to streptococci of Lancefield group B : a study of 33 infants. J Pediatr, 1973, 82, 724-9.5. Ducoffre G.— Surveillance des maladies infectieuses par un réseau de laboratoire de microbiologie 1997 + Tendances épidémiologiques 1983 - 1996, 1998; Septicémies et méningites néonatales. 1-2.6. Lancefield RC, Hare R.— The serological differentiation of pathogenic and non pathogenic strains of hemolytic streptococci from parturient women. J Exp Med, 1935, 61, 335-49.7. Kasper DL, Baker CJ.— Electron microscopic definition of surface antigens of group B streptococcus. J Infect Dis, 1979, 139, 147-51.8. Colman G.— Typing of Streptococcus agalactiae (Lancefield Group B). Eur J Clin Microbiol Infect Dis, 1988, 7, 226-31.9. Blumberg HM, Stephens DS, et al.— Invasive group B streptococcal disease : the emergence of serotype V. J Infect Dis, 1996, 173, 365-73.10. Baker CJ, Kasper DL.— Correlation of maternal antibody deficiency with susceptibility to neonatal group B streptococcal infection. NEJM, 1976, 294, 753-756.11. Baker CJ, Edwards MS, Kasper DL.— Role of antibody to native type III polysaccharide of group B streptococcus in infant infection. Pediatrics, 1981, 68, 544-9.12. Regan JA, Klebanoff MA, Nugent RP.— The epidemiology of group B streptococcal colonization in pregnancy. Vaginal infections and prematurity Study group. Obstet Gynecol, 1991, 77, 604-10.13. Anthony BF, Okada DM, Hobel CJ.— Epidemiology of group B streptococcus: longitudinal observation during pregnancy. J Infect Dis, 1978, 137, 524-30.14. Franciosi RA, Knostman JD, Zimmerman RA.— Group B streptococcal neonatal and infant infections. J Pediatr, 1973, 82, 707-18.15. Yow MD, Leeds LJ, Thompson PK, et al.— The natural history of group B streptococcal colonization in pregnant woman and her offspring. I. Colonizations studies. Am J Obstet Gynecol, 1980, 137, 34-8.16. Baker CJ, Goroff DK, Alpert S, et al.— Vaginal colonization with group B streptococcus: a study of college women. J Infect Dis, 1977, 135, 392-7.17. Boyer KM, Gadzala CA, Kelly PD, et al.— Selective intrapartum chemoprophylaxis of neonatal group B streptococcal early-onset disease. II. Predictive value of prenatal cultures. J Infect Dis, 1983, 148, 802-9.18. Ferrieri P et al.— Epidemiology of group B streptococcal carriage in pregnant women and newborn infants. J Med Microbiol, 1977, 10, 103-1419. Anthony BF, Okada DM, Hobel CJ.— Epidemiology of the group B streptococcus: maternal and nosocomial sources for infant acquisitions. J Pediatr, 1979, 95, 431-6.20. Ancona RJ, Ferrieri P, Williams PP.— Maternal factors that enhance the acquisition of group B streptococci by newborn infants. J Med Microbiol, 1980, 13, 273-80.21. Aber RC, Allen N, Howell JT, et al.— Nosocomial transmission of group B streptococci. Pediatrics, 1976, 58, 346-53.22. Paredes A, Wong P, et al.— Nosocomial transmission of group B streptococci in a newborn nursery. Pediatrics, 1977, 59, 679-82.23. Siegel JD, McCracken GH Jr, Threlkeld N, et al.— Single-dose penicillin prophylaxis against neonatal group B streptococcal infections : a controlled trial in 18,738 newborn infants. N Engl J Med, 1980, 303, 769-75.24. Schuchat A, Deaver-Robinson K, Plikaytis BD, et al.— Multistate case-control study of maternal risk factors for neonatal group B streptococcal disease. Pediatr Infect Dis J, 1994, 13, 623-9.25. Melin P.— Rapport annuel du laboratoire de référence "Streptococcus agalactiae". Surveillance des maladies infectieuses par un réseau de laboratoire de microbiologie 1997 + Tendances épidémiologiques 1983 - 1996, 1998, strep. aga. 1-3.26. Schuchat A, Oxtoby M, Cochi S, et al.— Population-based risk factors for neonatal group B streptococcal disease: results of a cohort study in metropolitan Atlanta. J Infect Dis, 1990, 162, 672-7.27. Miller JM Jr, Pupkin MJ, Hill GB.— Bacterial colonization of amniotic fluid from intact fetal membranes. Am J Obstet Gynecol, 1980, 136, 796-804.28. Faxelius G, Bremme K, Kvist-Christensen K, et al.— Neonatal septicemia due to group B streptococci-perinatal risk factors and outcome of subsequent pregnancies. J Perinat Med, 1988, 16, 423-30.29. Zangwill KM, Schuchat A, Wenger JD.— Group B streptococcal disease in the United States, 1990 : report from a multistate active surveillance system. MMWR CDC Surveill Summ, 1992, 41, 25-32. |
30. Schuchat A, Wenger JD.— Epidemiology of group B streptococcal disease : risk factors, prevention strategies, and vaccine development. Epidemio Rev, 1994, 16, 374-402.31. Wood EG, Dillon HC Jr.— A prospective study of group B streptococcal bacteriuria in pregnancy. Am J Obstet Gynecol, 1981, 140, 515-20.31.32. Pass MA, Gray BM, Dillon HC Jr.— Puerperal and perinatal infections with group B streptococci. Am J Obstet Gynecol, 1982, 143, 147-52.33. Schartz B, Schuchat A, Oxtoby MJ, et al.— Invasive group B streptococcal disease in adults : a population-based study in metropolitan Atlanta. JAMA, 1991, 266, 1112-14.34. Tuppurainem N, Hallman M.— Prevention of neonatal group B streptococcal disease : intrapartum detection and chemoprophylaxis of heavily colonized parturients. Obstet Gynecol, 1989, 73, 583-7.35. Gotoff SP, Odell C, Paperniak CK, et al.— Human IgG antibody to group B streptococcus type III: Comparison of protective levels in a murine model with levels in infected human neonates. J Infect Dis, 1986, 153, 511-19.36. Newton ER, Prihoda TJ, Gibbs RS.— Logistic regression analysis of risk factors for intra-amniotic infection. Obstet Gynecol, 1989, 73, 571-5.37. Soper DE, Mayhall CG, Dalton HP.— Risk factors for intra-amniotic infection: a prospective epidemiologic study. Am J Obstet Gynecol, 1989, 161, 562-8.38. Baker CJ, Kasper DL.— Group B streptococcal vaccines. Rev Infect Dis, 1985, 7, 458-67.39. Baker CJ, Rench MA, Edwards MS, et al.— Immunization of pregnant women with a polysaccharide vaccine of group B streptococcus. N Engl J Med, 1988, 319, 1180-5.40. Paoletti LC, Kasper DL, Michon F, et al.— An oligosaccharide-tetanus toxoid conjugate vaccine against type III group B streptococcus. J Biol Chem, 1990, 265, 18278-83.41. Kotoff KL, Fattom A, Basham L, et al.— Safety and immunogenicity of a tetravalent group B streptococcal polysaccharide vaccine in healthy adults. Vaccine, 1996, 14, 446-50.42. Wessels MR, Paoletti LC, Rodewald AK, et al.— Stimulation of protective antibodies against type Ia and Ib group B streptococci by a type Ia polysaccharide-tetanus toxoid conjugate vaccine. Infect Immun, 1993, 61, 4760-6.43. Baker CJ.— Immunization to prevent group B streptococcal disease : victories and vexations. J Infect Dis, 1990, 161, 917-21.44. Hall RT, Barnes W, Krishnan L, et al.— Antibiotic treatment of parturient women colonized with group B streptococci. Am J Obstet Gynecol, 1976, 124, 630-4.45. Gardner SE, Yow MD, Leeds LJ, et al.— Failure of penicillin to eradicate streptococcal colonization in the pregnant woman: a couple study. Am J Obstet Gynecol, 1979, 135, 1062-5.46. Yow MD, Mason EO, Leeds LJ, et al.— Ampicillin prevents intrapartum transmission of group B streptococcus. JAMA, 1979, 241, 1245-7.47. Easmon CSF, Hastings MJG, Deeley J, et al.— The effect of intrapartum chemoprophylaxis on the vertical transmission of group B streptococci. Br J Obstet Gyneacol, 1983, 90, 633-548. Boyer KM, Gotoff SP.— Prevention of early-onset neonatal disease with selective intrapartum chemoprophylaxis. N Engl J Med, 1986, 314, 1665-9.49. Boyer KM, Gadzala CA, Burd LI, et al.— Selective intrapartum chemoprophylaxis of neonatal group B streptococcal early-onset disease. I. Epidemiological rationale. J Infect Dis, 1983, 148, 795-801.50. Morales WJ, Lim DV, Walsh AF.— Prevention of neonatal group B streptococcal sepsis by the use of a rapid screening test and selective intrapartum chemoprophylaxis. Am J Obstet Gynecol, 1986, 155, 979-83.51. American College of Obstetricians and Gynecologists.— Group B streptococcal Infections in pregnancy. American College of Obstetricians and Gynecologists, Washington DC, 1992. (ACOG technical bulletin n° 170).52. American Academy of Pediatrics.— Committee on Infectious Diseases and Committee on Fetus and Newborn. Guidelines for prevention of group B streptococcal (GBS) infection by chemoprophylaxis. Pediatrics, 1992, 90, 775-8.53. Rouse DJ, Goldenberg RL, Cliver SP, et al.— Strategies for prevention of early-onset neonatal group B streptococcal sepsis : a decision analysis. Obstet Gynecol, 1994, 83, 483-94.54. Yancey MK, Duff P.— An analysis of the cost-effectiveness of selected protocols for the prevention of neonatal group B streptococcal infection. Obstet Gynecol, 1994, 83, 367-71.55. CDC.— Prevention of perinatal group B streptococcal disease : a public health perspective. MMWR, 1996, 45 (n° RR-7).56. Yancey MK, Schuchat A et al.— The accuracy of late antenatal screening cultures in predicting genital group B streptococcal colonization at delivery. Obstet Gynecol, 1996, 88, 811-5.57. Yancey MK, Armer T, Clark P, et al.— Assessment of rapid identification tests for genital carriage of group B streptococci. Obstet Gynecol, 1992, 80, 1038-4758. Melin P.— Strep B International Symposium : Diagnosis and prevention of strep B neonatal disease. October 1997 Vail, USA, 8-12. |
e-mail
: micromed@ulg.ac.be
Mise à jour
: 20 février 1999 / Responsable : Pierrette Melin
| Page d'acceuil |